Fiocruz solicita uso emergencial da vacina de Oxford à Anvisa
A Agência Nacional de Vigilância Sanitária (Anvisa) recebeu nesta sexta-feira (8) o pedido de autorização do uso emergencial da vacina de Oxford pela Fundação Oswaldo Cruz. A Fiocruz conduz os estudos do imunizante desenvolvido pela farmacêutica AstraZeneca no Brasil.
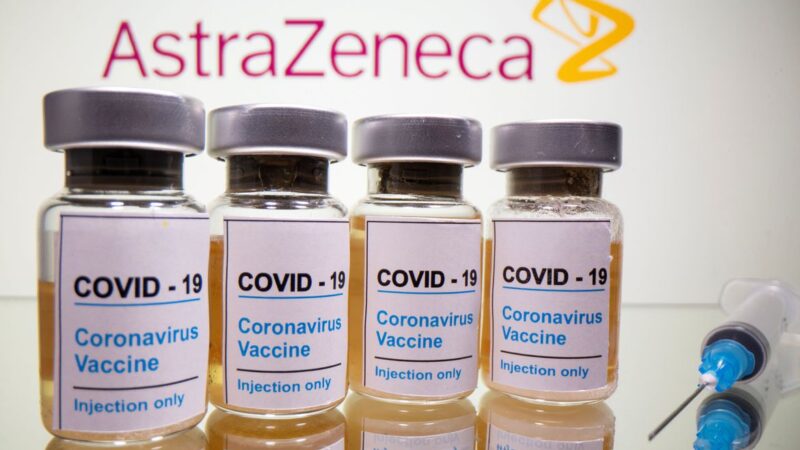
Segundo a Anvisa, o pedido da Fiocruz é para o uso de 2 milhões de doses de vacinas que devem ser importadas do laboratório Serum, sediado na Índia. O laboratório é um dos fabricantes da vacina da AstraZeneca.
“As primeiras 24 horas serão utilizadas para fazer uma triagem do processo e checar se os documentos necessários estão disponíveis. Se houver informação importante faltando, a Anvisa pode solicitar as informações adicionais ao laboratório. O prazo de 10 dias não considera o tempo do processo em status de exigência técnica”.
A eficácia geral da vacina de Oxford/AstraZeneca é de 70%. Um erro na dosagem nos testes fez com a comunidade dos cientistas colocassem em dúvida a credibilidade do imunizante.
Por engano, parte das pessoas que se voluntariaram para os testes receberam meia dose e depois uma dose completa, em vez das duas doses inteiras como estava previsto na metodologia do estudo. Como resultado, a vacina registrou dois níveis diferentes de eficácia. O imunizante foi mais eficaz para as pessoas que receberam uma dose e meia (90%) do que entre quem recebeu duas doses (62%).
Entretanto, no início do mês passado, a revista científica Lancet publicou uma revisão dos testes com a alegação de que a vacina oferece 90% de proteção a voluntários que receberam uma dose e meia. A eficácia geral, porém, foi de 70%.
“A meta da Anvisa é fazer a análise do uso emergencial em até 10 dias, descontando eventual tempo que o processo possa ficar pendente de informações, a serem apresentadas pelo laboratório”, comunicou a agência.
Butantan protocola pedido de uso emergencial da vacina Coronavac à Anvisa
Mais cedo, o Instituto Butantan entregou o pedido de uso emergencial da vacina Coronavac à Anvisa. A agência informou que já iniciou a triagem do documentos presentes na solicitação do Instituto Butantan e da proposta de uso emergencial que o laboratório pretende fazer da Coronavac.
Na última quinta-feira (7), o Instituto Butantan informou que a Coronavac teve eficácia de 78% para casos leves na terceira fase de testes com cerca de 13 mil voluntários no Brasil.
Segundo o Instituto, a vacina garantiu proteção total contra mortes, casos graves e internações nos voluntários vacinados que foram contaminados. As etapas anteriores já haviam testado a segurança e a eficácia da vacina.